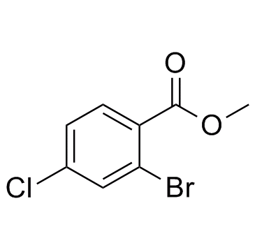
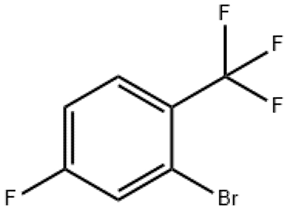
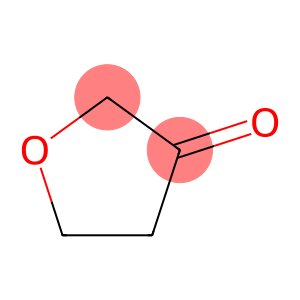
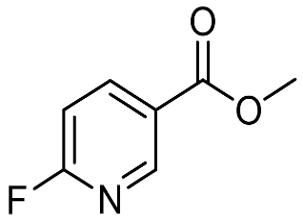
alfa-Ionón (CAS č. 127-41-3)
| Rizikové kódy | R42/43 – Môže spôsobiť senzibilizáciu po vdýchnutí a kontakte s pokožkou. |
| Popis bezpečnosti | S24/25 – Zabráňte kontaktu s pokožkou a očami. |
| WGK Nemecko | 2 |
| RTECS | EN0525000 |
| TSCA | áno |
| Kód HS | 29142300 |
alfa-Ionón (CAS č. 127-41-3) informácie
Fialový ketón, tiež známy ako benzofenón, je organická zlúčenina. Tu sú niektoré bezpečnostné informácie o ionone:
1. Toxicita: Fialový ketón má určitú toxicitu pre ľudské telo. Môže spôsobiť poškodenie centrálneho nervového systému a pečene a môže mať nepriaznivé účinky na reprodukčný systém a embryá.
2. Nebezpečenstvo vdýchnutia: Vdychovanie pár alebo prachu ionónu môže spôsobiť nepríjemné symptómy, ako sú závraty, ospalosť, kašeľ a ťažkosti s dýchaním. Dlhodobá expozícia môže spôsobiť poškodenie centrálneho nervového systému.
3. Nebezpečenstvo kontaktu: Fialový ketón sa môže absorbovať cez pokožku. Dlhodobý alebo rozsiahly kontakt môže spôsobiť podráždenie pokožky a očí. Pri manipulácii s ionónom by sa mali používať vhodné osobné ochranné prostriedky, ako sú rukavice a bezpečnostné okuliare.
4. Protipožiarne opatrenia: V prípade úniku alebo požiaru použite na uhasenie požiaru suchý prášok, penu alebo oxid uhličitý. Nepoužívajte vodu, pretože fialový ketón reaguje s vodou za vzniku horľavých plynov.
5. Likvidácia odpadu: Odpadový fialový ketón zlikvidujte správne v súlade s miestnymi predpismi a pravidlami. Nevylievajte ho do kanalizácie ani do odpadkového koša.
6. Bezpečnostné opatrenia pri skladovaní: Fialový ketón by sa mal skladovať na chladnom, suchom a dobre vetranom mieste, mimo zdrojov ohňa a oxidantov.
Tieto informácie sú len orientačné. Ak je potrebné ďalšie použitie alebo spracovanie iononu, pozrite si príslušnú kartu bezpečnostných údajov a poraďte sa s odborníkom.
prírody
Fialový ketón, tiež známy ako linaylketón, je prírodná ketónová zlúčenina. Je hlavnou zložkou vône kvetov fialky.
Fialový ketón je bezfarebná až svetložltá olejovitá kvapalina, ktorá je pri izbovej teplote prchavá.
Fialový ketón je rozpustný v alkohole a éterových rozpúšťadlách a mierne rozpustný vo vode. Jeho hustota je relatívne nízka, s hustotou 0,87 g/cm³. Je citlivý na svetlo a dokáže absorbovať ultrafialové lúče.
Fialový ketón môže byť oxidovaný na ketónalkoholy alebo kyseliny v chemických reakciách a môže byť redukovaný na alkoholy prostredníctvom hydrogenačných redukčných reakcií. Môže podstúpiť alkylačné a esterifikačné reakcie s mnohými zlúčeninami.
Aplikácia a metóda syntézy
Fialový ketón (tiež známy ako fialový ketón) je aromatická ketónová zlúčenina. Má špeciálnu vôňu a často sa používa v parfumérskom a voňavkárskom priemysle. Nasleduje úvod do použitia a metód syntézy ionónu:
Účel:
Parfum a korenie: vonné vlastnosti ionónu, ktorý sa široko používa v priemysle parfumov a korenín na výrobu produktov s fialovou vôňou.
Metóda syntézy:
Syntéza ionónu sa vo všeobecnosti dosahuje pomocou nasledujúcich dvoch metód:
Oxidácia nukleobenzénu: Nukleobenzén (benzénový kruh s metylovým substituentom) sa podrobí oxidačnej reakcii, ako je použitie oxidačnej kyseliny alebo kyslého roztoku manganistanu draselného, aby sa vytvoril ionón.
Väzba pyrylbenzaldehydu: Pyrylbenzaldehyd (ako je benzaldehyd so substituentmi pyridínového kruhu v polohe para alebo meta) reaguje s anhydridom kyseliny octovej a inými reaktantmi za alkalických podmienok za vzniku ionónu.